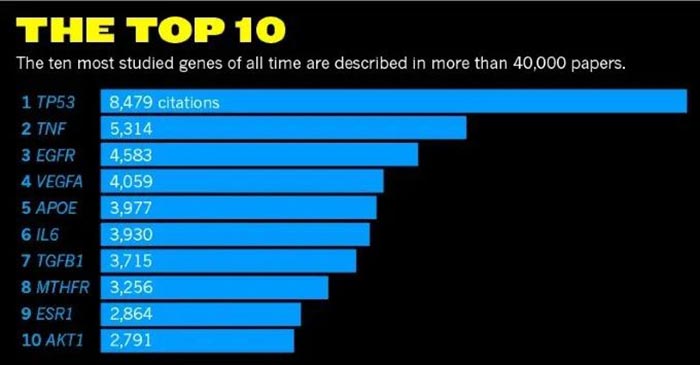
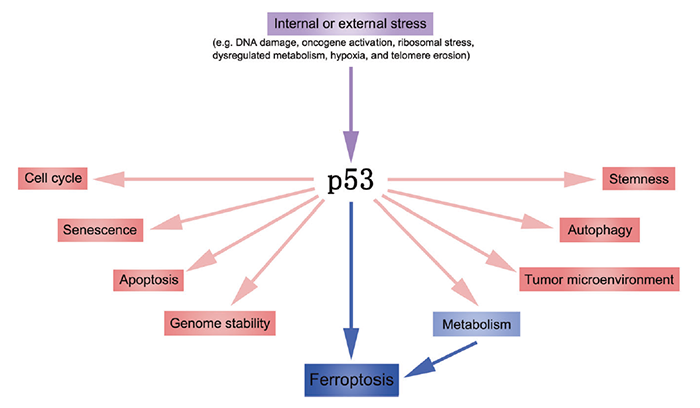
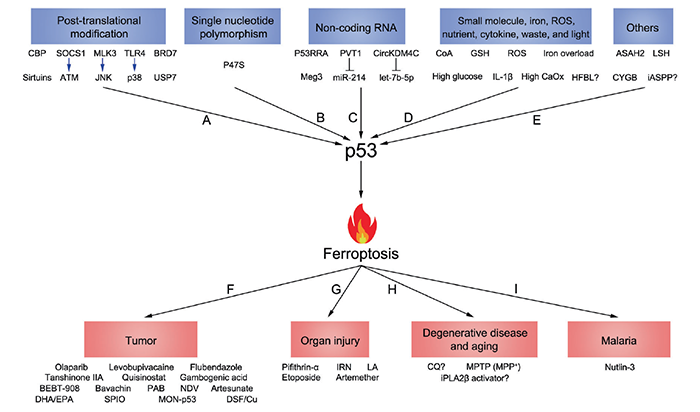
自1979年被发现以来,p53一直是肿瘤学研究的焦点之一。在Pubmed数据库中用p53为关键词搜索,可以找到超过十万篇文献。这些文献绝大多数关注p53在肿瘤中的作用。事实上,p53在肿瘤之外(比如发育,干细胞,以及一些非肿瘤疾病等)也有重要功能。p53可以被大量细胞内/外刺激和压力(Stresses,包括DNA damage, oncogene activation, ribosomal or telomere-associated stresses, and nutrient deprivation等)所诱导,作为转录因子调节多种多样下游基因的表达,在细胞和机体层面产生多种效果(cell cycle arrest, DNA repair, senescence, apoptosis, and ferroptosis等),从而帮助细胞/机体对抗刺激。p53也可以不依赖其转录因子活性而行使功能。在多种肿瘤中,p53是一个拥有广泛而强大功能的抑癌基因,超过一半的肿瘤患者带有p53突变。p53单位点突变可能导致家族性的李-佛美尼综合症(Li-Fraumeni syndrome)。p53 KO小鼠会在发育早期就形成肿瘤。自从1979年p53基因被发现以来,p53一直是分子生物学和肿瘤学的“明星分子”。在 Nature 杂志2017年的一项统计中,p53以绝对优势位列过去几十年最热门研究基因榜第一名。p53主要作为转录因子,激活或者抑制多种下游靶基因的转录来行使功能。这些靶基因的作用主要包括诱导细胞周期停滞,DNA修复,调节细胞代谢,细胞衰老,细胞凋亡,以及新近发现的诱导细胞发生铁死亡(ferroptosis)等(图1)。但是,p53的诸多功能里哪一项/哪几项才是真正起到抑制肿瘤的作用?关于这个问题,学术界一直存在一些争议。近日,哥伦比亚大学医学中心顾伟教授及其博士后刘彦卿博士在 Cell Death & Differentiation 期刊发表了题为:p53 in ferroptosis regulation: the new weapon for the old guardian 的综述论文。该综述全面梳理总结了p53在铁死亡调节中的复杂作用。2012年以前,学界认为p53的诱导细胞周期停滞,衰老或者凋亡(cell cycle arrest, senescence, and apoptosis)已经足以解释其抑癌功能。然而在2011-2013年,三项研究(2篇Cell+1篇Cell Reports)推翻了这一观点。其中最重要的一篇文章来自于美国哥伦比亚大学医学院顾伟教授实验室(Cell, 2012)。
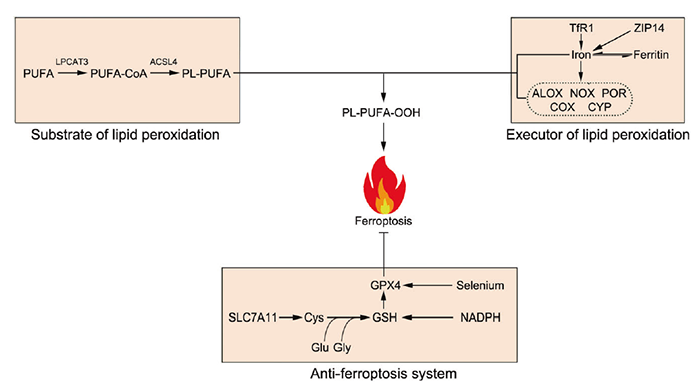
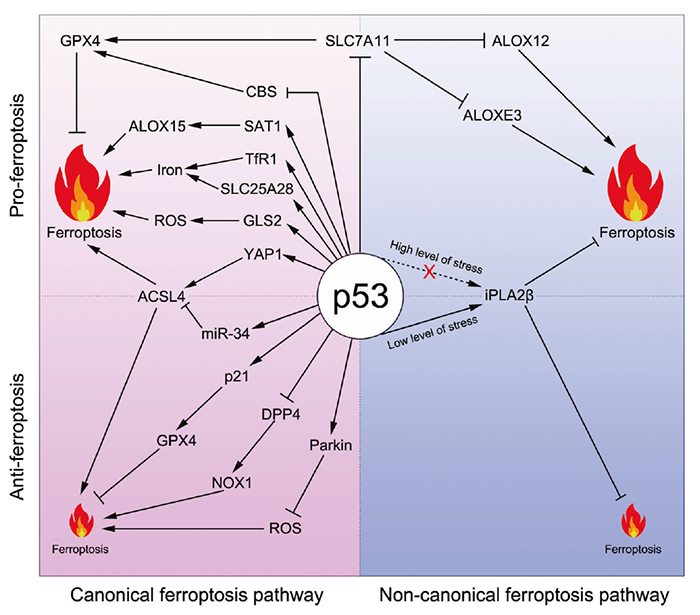
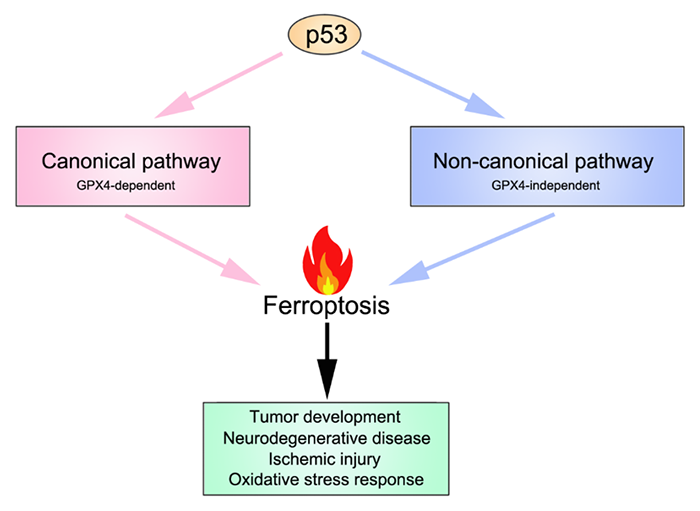
顾伟教授是p53领域的国际权威科学家之一。在过去二十多年的研究里,顾伟教授实验室诞生了p53功能及调控的多项重要成果(主要结论发表在十余篇CNS及数篇CNS子刊之上)。2012年,顾伟实验室利用p53功能突变小鼠,发现p53在失去诱导三项经典抑癌功能(细胞周期停滞,衰老或者凋亡)后,依然可以有抑癌功能(Cell, 2012)。特别地,该p53突变体在丧失激活多个传统经典p53靶基因(PUMA,NOXA以及p21等)功能的同时,依然可以激活一些代谢相关的靶基因。这提示了代谢调节功能可能是p53抑制肿瘤的关键。接下来的几年,顾伟课题组多项成果揭示了p53通过调节肿瘤代谢活动而抑制肿瘤(Nature, 2015; PNAS, 2016; Cell Reports, 2017; Nature Cell Biology, 2019; Genes&Development, 2021)。那么p53具体哪一项/哪几项代谢调节功能是其抑制肿瘤最重要的?另一个问题是:p53激活后,是通过何种机制来杀死肿瘤细胞的?如果能找到一种p53调节的、与代谢密切相关的细胞死亡方式,可能就找到了p53抑癌的最基本机制。那么是否存在这种机制?目前的研究表明:铁死亡就极有可能是这个问题的答案。铁死亡是哥伦比亚大学 Brent Stockwell 教授在2012年发现的一种细胞死亡形式。根据Stockwell教授的总结,铁死亡包含三个基本hallmarks:(1)GPX4的失活;(2)过量的活性铁;(3)细胞膜脂的多不饱和脂肪酸(PUFA)被氧化(图2)。在这个模型里,有两个重要的蛋白ACSL4(负责将PUFA共价连接到细胞膜上)和GPX4(还原被氧化的细胞膜PUFA,阻止铁死亡的发生)。这里面GPX4又是最为重要的一个蛋白,是经典的铁死亡模型的核心。然而,随着研究的深入,越来越多不满足经典模型的铁死亡调节通路被发现。因此,我们提出一个更广泛的铁死亡模型来包含所有被发现的铁死亡通路。在这个模型里,铁死亡依然由三部分组成:substrate of lipid peroxidation, executor of lipid peroxidation, and anti-ferroptosis system。铁死亡涉及三种核心代谢物:铁,脂质和活性氧(ROS)。鉴于p53可以参与这三者的代谢调控,可以推断p53也许能够参与调节铁死亡(图3)。顾伟实验室在2015年的一篇 Nature 论文里首次揭示了p53可以通过促进细胞发生铁死亡从而抑制肿瘤发展。胱氨酸/谷氨酸反转运体xCT由两个亚基(SLC7A11和SLC3A2)组成,可以在向细胞内转入L-胱氨酸的同时1:1地转出L-谷氨酸。胱氨酸Cystine是半胱氨酸Cys的二聚体。半胱氨酸是合成谷胱甘肽GSH的重要成分。而GSH正是最主要的铁死亡抑制蛋白GPX4的还原力供体。Cys的缺乏会导致细胞GSH合成不足,从而影响到GPX4的正常功能,导致细胞发生铁死亡。这篇 Nature 论文里首次发现p53可以转录水平抑制SLC7A11表达,从而促进细胞发生铁死亡,导致肿瘤抑制。进一步的研究表明,p53 K101的乙酰化对于p53抑制SLC7A11有重要作用。有趣的是,p53 3KR突变体在丧失诱导细胞周期停滞,衰老或者凋亡的同时,保留了抑制SLC7A11从而诱导铁死亡(和抑制肿瘤)。但是p53 4KR突变体以及一个非洲人来源p53 SNP P47S却失去了抑制SLC7A11和诱导铁死亡(以及抑制肿瘤)的功能。这些结果表明诱导铁死亡可能是p53抑制肿瘤的最重要武器。2019年,顾伟实验室一篇 Nature Cell Biology 论文证明了p53-SLC7A11轴还可以通过GSH非依赖的方式来促进铁死亡。文章发现脂质氧化酶ALOX12是p53依赖的铁死亡发生的关键调控因子。但是SLC7A11却可以直接结合ALOX12从而限制其功能。当p53下调SLC7A11的同时,会释放ALOX12。游离的ALOX12可以氧化细胞膜磷脂的多不饱和脂肪酸链,导致细胞发生铁死亡。类似地,也有人发现ALOXE3也可以像ALOX12一样被SLC7A11抑制。另外,顾伟实验室2016年的一篇 PNAS 论文发现p53可以诱导SAT1的表达,从而促进ALOX家族另一个成员ALOX15的功能以增强细胞铁死亡。2015年,MSKCC的姜学军教授团队在一篇 Molecular Cell 论文里报道Glutaminolysis可以促进铁死亡的发生(第一作者为哈工大生命科学中心高明辉研究员)。而p53的靶基因GLS2能够催化Glutaminolysis过程,也许会对铁死亡有影响。另外顾伟实验室还发现p53能够调节PHGDH以抑制Ser的合成,也许可以影响GSH合成来促进铁死亡。此外,p53还能通过诱导lncRNA PVT1表达或者直接结合线粒体铁转运蛋白SLC25A28来促进铁死亡。而铁死亡的两个标志分子PTGS2和CBS也都被证明是p53的靶基因。上述大量的证据支持了p53对于铁死亡的促进作用。然而就像之前提过的其它代谢过程,p53也被证明在某些情况下抑制铁死亡的发生。细胞周期调节蛋白p21是p53的重要靶基因。p21可以抑制细胞周期的进行,从而将部分用于合成核酸的原料转为合成还原力NADPH和GSH--这将抑制铁死亡的发生。另外,德州大学西南医学中心的唐道林教授一篇Cell Reports论文发现:在结直肠癌里p53可以直接结合DPP4从而将之束缚在细胞核内。DPP4将不能到细胞质中结合NOX1来促进铁死亡的发生。最近,顾伟实验室发现了p53的一个新靶基因iPLA2β能够通过切断被氧化的细胞膜PUFA来抑制铁死亡。有趣的是:当外界刺激较小的时候,p53激活iPLA2β的表达,从而抑制铁死亡;但是当外界刺激超过一定阈值,p53不再能够激活iPLA2β,从而转为促进铁死亡的发生。这一two-phase的作用模型在p53调节ROS,细胞凋亡等功能里均有体现。这反映了p53作为细胞守护者(guardian of the cell),在内外刺激程度较轻,细胞能够承受的时候,倾向于降低刺激的后果,保护细胞不受伤害;而一旦刺激剧烈,细胞难以承受,有破坏基因组或者导致肿瘤的风险时,p53则会清除掉这些细胞,从而保护整个机体。特别需要指出的是:上述p53/SLC7A11/ALOX12和p53/iPLA2β两条通路均不依赖于GPX4和ACSL4。这表明这两条通路是有别于Stockwell提出的铁死亡经典模型,代表着一类全新的铁死亡机制。图3-p53既能调节经典铁死亡,也能调节非经典的铁死亡综合起来,尽管有少数反例存在(可能是因为实验中细胞类型的不同),p53在绝大多数情况下能够促进细胞发生铁死亡,从而抑制肿瘤。p53介导的铁死亡本身也受到多种更上游的机制的调节(图4)。以p53为中心的铁死亡为治疗肿瘤(尤其是p53突变的肿瘤)以及其它疾病(主要包括神经退行性疾病,缺血/再灌注导致的器官损伤等)提供新的思路(图4)。图4-p53-ferroptosis通路受到多种调节;靶向这条通路可以治疗多种疾病总结起来,p53所调控的铁死亡是与传统以GPX4为中心的铁死亡模型既有区别又有联系的一种铁死亡基本通路。以顾伟教授实验室成果为代表的一批论文挑战了传统的GPX4/ACSL4/ferroptosis模型。同时,这些新成果也为铁死亡的研究提出了一些重要启示。比如:这两种模型在生理病理条件下有何区别?目前一种推测是:GPX4通路主要是在生理条件下起作用。铁死亡是细胞正常活动无法避免的一种死亡形式。为了降低生理状态下铁死亡对细胞的伤害,GPX4可以抑制铁死亡,使之处于一个basal水平。而当细胞受到内外刺激,比如癌症等疾病状态下,p53通路则发挥作用,要么抑制低水平的铁死亡来保护细胞,要么诱发高水平的铁死亡来清除受到损伤的细胞。另外一个重要问题是:在铁死亡研究里,该如何来诱发铁死亡?目前最常见的诱导铁死亡的方式(包括SLC7A11抑制剂Erastin和GPX4抑制剂ISL3等)均是针对传统的GPX4通路,而并不针对p53通路。这也可以解释为何多数研究里,ACSL4是GPX4通路所必需的。因为当初Stockwell等人只知道有GPX4通路,所以采取抑制GPX4,然后去寻找对于这条通路重要的调控蛋白,从而找到了ACSL4。但是,当p53通路被发现之后,为铁死亡的机制增加了复杂性。p53既参与GPX4通路的调节,也能调节不依赖GPX4的铁死亡通路。那么如果只是使用抑制GPX4通路来诱导铁死亡,则不仅仅不能诱导一个全面的铁死亡水平,而且不能有效反映某些病理状态下的真实情况。因此,可能要考虑通过干扰这两条铁死亡通路所共用的成分,比如Iron的水平来诱导更全面的铁死亡状态。另外,由于p53抑制SLC7A11既参与GPX4依赖的铁死亡,又参与GPX4非依赖的铁死亡,那么当研究者在自己的实验中观察到调节p53引起SLC7A11以及细胞铁死亡水平变化的时候,对于这个过程具体机制的解释不能仅仅局限于p53/SLC7A11/GPX4这个机制,还要考虑可能是通过p53/SLC7A11/ALOX这条通路来起作用。该综述论文通讯作者为哥伦比亚大学医学中心顾伟教授,第一作者为顾伟教授实验室刘彦卿博士。顾伟,1986年毕业于北京大学,1995年获美国哥伦比亚大学博士学位,1995-1998在洛克菲勒大学从事博士后研究(导师为真核生物RNA聚合酶发现者、拉斯克奖得主 Robert Reoder 教授)。1999年入职哥伦比亚大学。2007年至今在哥伦比亚大学医学中心担任正教授、哥伦比亚大学Institute for Cancer Genetics的Abraham and Mildred Goldstein Professor。顾伟教授主要从事p53在肿瘤中的功能和机制研究。他在p53相关调控通路(特别是p53乙酰化和泛素化)研究领域取得了杰出成就,在 Cell、Nature、Science、Nature Cell Biology、Nature Genetics、Molecular Cell 和Cell Metabolism等国际权威杂志上发表论文50余篇,包括以通讯作者在Cell(7篇)、Nature(6篇)和Science(1篇)发表论文14篇,论文总被引44500次,并担任Cell、Nature和Science等国际权威期刊的特约审稿人。https://www.nature.com/articles/s41418-022-00943-y